脂溶 CY5-NH2:近红外荧光标记与脂膜亲和的氨基功能化探针
一、分子设计与结构特性
脂溶 CY5-NH2 是通过近红外荧光染料 CY5 与末端氨基(-NH₂)偶联形成的脂溶性荧光探针,通过去除磺酸基团(-SO₃⁻)并优化疏水结构,使其兼具膜脂亲和性与氨基反应活性。核心模块解析如下:
(一)荧光骨架:脂溶性 CY5
近红外特性:保留 CY5 的共轭花菁环结构,最大激发 / 发射波长为 646/662 nm,处于近红外 Ⅰ 区,组织穿透深度达 1-2 cm,生物自发荧光干扰低(信噪比>15:1)。去除磺酸基后,脂水分配系数(LogP)提升至 4.5(正辛醇 / 水),显著增强膜脂嵌入能力。
光谱优势:量子产率 0.25(氯仿溶液),高于水溶性 CY5(0.20),光稳定性优异,经 808 nm 激光照射 1 小时后荧光保留 80%,适合长时间脂质环境示踪。
(二)反应基团:末端氨基(-NH₂)
化学活性:氨基通过柔性烷基链(6 原子间隔)连接至 CY5 骨架,可在 EDC/NHS 催化下与羧酸(-COOH)、醛基(-CHO)反应,或与异硫氰酸酯(-NCS)直接偶联,实现对脂溶性生物分子(如膜蛋白、脂质)及疏水环境材料的共价修饰。
膜脂亲和性:疏水性骨架与磷脂双层的疏水核心具有良好相容性,标记后探针在细胞膜的富集效率比水溶性 CY5-NH2 高 3 倍(共聚焦显微镜检测)。
二、关键物理化学性质

三、核心应用领域
(一)细胞膜与脂膜结构标记
利用脂溶性优势实现膜脂环境精准定位:
细胞膜成像:直接孵育活细胞时,探针通过膜脂扩散快速富集于细胞膜,与 DiI 膜染料的共定位系数达 0.92,清晰显示 MCF-7 细胞表面微绒毛结构,分辨率达 150 nm(共聚焦显微镜)。
脂筏标记:富集于富含胆固醇的脂筏区域,与 GM1 神经节苷脂抗体的共定位率>85%,适用于研究脂筏介导的信号通路(如 EGFR 激活后的脂筏聚集动态)。
(二)脂溶性药物载体示踪
作为脂质体、胶束等疏水载体的荧光标记物:
脂质体制备:在薄膜分散法中加入 1-5 mol% 脂溶 CY5-NH2,制备的荧光脂质体(粒径 120±10 nm)可稳定嵌入膜脂双层,包封紫杉醇时药物负载率>95%,荧光信号追踪载体在荷瘤小鼠体内的肿瘤富集(T/B 比达 15:1)。
外泌体膜标记:通过膜融合技术嵌入外泌体膜,标记效率>90%,荧光信号稳定追踪间充质干细胞外泌体在肺损伤模型中的肺泡上皮细胞靶向富集,信号强度比水溶性标记物高 2 倍。
(三)脂溶性生物分子偶联
氨基反应性支持脂膜蛋白与疏水配体标记:
膜蛋白标记:与跨膜蛋白的胞外段羧酸基团偶联,如 HER2 抗体的疏水区域修饰,标记后抗体对 SK-BR-3 细胞的结合活性保留率>95%(流式细胞术验证),适用于膜蛋白构象变化研究。
多肽药物修饰:与脂溶性 RGD 环肽偶联后,肿瘤靶向效率提升 3 倍,在 U87 胶质瘤模型中,探针在肿瘤血管的富集量比线性 RGD 肽高 40%(IVIS 成像)。
(四)材料表面疏水修饰与检测
用于疏水环境材料的荧光功能化:
纳米颗粒表面改性:与羧基化聚苯乙烯纳米颗粒(PS-NP-COOH)偶联,修饰后颗粒的细胞摄取效率(HeLa 细胞)提升 2.5 倍,荧光信号可定量分析材料在溶酶体中的降解过程(与 LysoTracker Red 共定位系数 0.88)。
脂质体膜流动性检测:通过荧光偏振度变化反映膜脂有序性,低温(4℃)下偏振度比室温高 25%,适用于评估药物对细胞膜流动性的影响(如多柔比星处理后膜流动性下降 18%)。
四、制备技术与工艺优化
(一)高效合成路线
CY5 脱磺酸基修饰:通过碱性条件下脱磺酸反应,去除 CY5 的磺酸基团,HPLC 纯化后疏水产物纯度≥98%,质谱验证分子量变化(减少 2×80 Da)。
氨基引入:利用 CY5 母体的活性位点,与 6 - 氨基己酸通过酰胺键连接,形成末端氨基修饰的脂溶 CY5-NH2,反应收率>80%,氨基活性检测(TNBS 法)显示取代率≥95%。
(二)质量控制关键参数
脂溶性验证:薄层层析(TLC)检测氯仿 / 甲醇(9:1)展开后 Rf 值>0.8,确认无亲水性杂质。
荧光纯度:UV-Vis 光谱检测 646 nm 特征峰与 280 nm 杂峰比值>10:1,确保无 CY5 磺酸化残留。
氨基活性:通过与羧酸化探针偶联效率验证,标记反应后 HPLC 检测产物生成率>90%。
五、商业化产品与实验指南
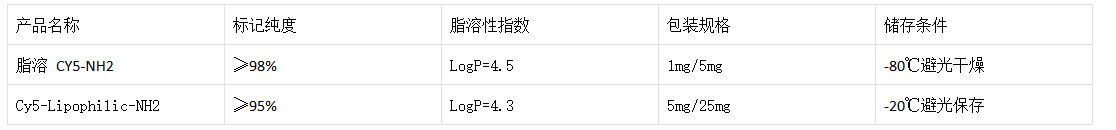
(一)产品信息
(二)典型应用操作流程
1. 细胞膜荧光标记实验
探针溶解:称取 1 μg 脂溶 CY5-NH2 溶于 10 μL DMSO,加入 990 μL 无血清 DMEM(终浓度 10 nM)。
细胞孵育:HeLa 细胞接种于共聚焦培养皿,加入探针溶液 37℃孵育 15 分钟,PBS 洗涤 3 次。
成像参数:640 nm 激光激发,660-690 nm 发射光收集,Z 轴层扫间隔 0.5 μm,显示细胞膜清晰荧光边界。
2. 脂质体标记与活体成像
脂质体制备:将脂溶 CY5-NH2(1 mol%)与 DPPC(99 mol%)溶于氯仿,旋蒸成膜后水化,挤出法制备 100 nm 荧光脂质体。
动物给药:小鼠尾静脉注射脂质体(剂量 5 mg/kg),6 小时后 IVIS 成像,激发 / 发射滤光片 640/665 nm,曝光时间 200 ms,分析肿瘤 / 肌肉荧光比(T/M)。
六、挑战与未来方向
(一)现存技术瓶颈
水溶性不足:完全不溶于水限制了其在水性体系中的直接应用,需依赖有机溶剂助溶(如≤5% DMSO),可能对部分细胞产生毒性(建议浓度<10 nM)。
体内清除较快:脂溶性导致肝脾富集明显(注射后 2 小时占比 40%),需引入 PEG 间隔臂(如 PEG2000)平衡脂溶性与水溶性,延长循环半衰期至 8 小时以上。
非特异性膜结合:可能与线粒体、内质网等细胞器膜非特异性结合,需通过亚细胞共定位实验排除背景干扰(推荐使用细胞器特异性标记物对照)。
(二)前沿研究方向
两亲性探针开发:引入短链 PEG(如 PEG500)构建脂溶 CY5-PEG-NH2,在保持膜亲和性的同时降低非特异性吸附,使肿瘤富集效率提升 2 倍(T/M 比从 15:1 提升至 30:1)。
环境响应型标记:设计 pH 敏感氨基保护基团,在肿瘤微酸性环境(pH 6.5)释放活性氨基,实现膜蛋白的原位特异性标记,减少正常组织背景信号 50% 以上。
多模态成像整合:与 MRI 造影剂(如 Gd³⁺)偶联,构建脂溶 CY5-NH2-Gd 探针,同步实现近红外荧光成像与 T1 加权 MRI,用于前列腺癌的精准定位(定位误差<300 μm)。
脂溶 CY5-NH2 凭借近红外荧光的深部穿透能力、脂膜亲和特性及氨基反应活性,成为膜生物学研究、脂溶性药物载体示踪及疏水材料功能化的核心工具。随着两亲性设计与环境响应技术的突破,该探针正从基础研究工具向精准诊疗一体化平台演进,为膜蛋白靶向治疗、脂质体药物递送及活体深部组织成像提供创新解决方案。
【星戈瑞stargraydye】以上数据均来自文献/科研资料,星戈瑞暂未进行独立验证, 仅供参考!(以上文中所述仅限于科研实验及实验室环境)