脂溶 CY7-NHS 酯:脂环境靶向的近红外氨基标记专家
脂溶 CY7-NHS 酯(Lipophilic CY7-NHS Ester)是基于花菁染料骨架开发的高性能荧光标记试剂,通过在 CY7 核心结构中引入 N - 羟基琥珀酰亚胺酯(NHS Ester)并去除磺酸基团,实现了脂溶性环境高亲和性、氨基特异性偶联及近红外长波长荧光性能的深度融合。其独特设计使其成为脂质体、细胞膜、脂锚定蛋白等脂环境相关生物分子标记的首选工具,尤其适用于深层组织成像和脂溶性药物递送系统示踪。
一、分子结构与核心特性
1. 脂溶性花菁骨架与活性基团协同设计
脂溶 CY7-NHS 酯的分子结构由三大功能模块构成:
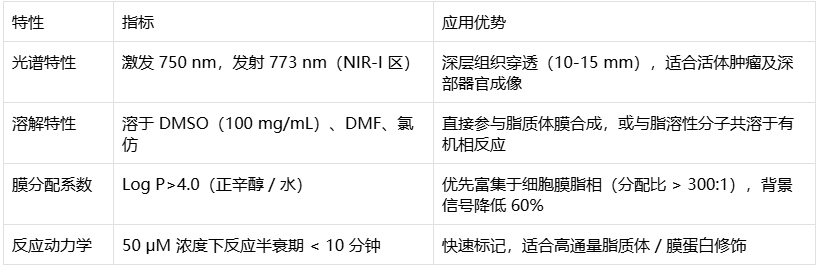
CY7 荧光核心:保留双吲哚花菁共轭体系,激发波长 750 nm,发射波长 773 nm,处于近红外 I 区(NIR-I),消光系数 > 199,000 M⁻¹cm⁻¹,量子产率约 0.3。长波长特性使其组织穿透深度可达 10-15 mm,显著减少生物自发荧光干扰。
疏水性烷基取代基:去除亲水性磺酸基团,引入长链烷基或环烷基,log P 值 > 4.0,易溶于 DMSO、氯仿等有机溶剂,可通过被动扩散高效嵌入脂质双层(如细胞膜、脂质体磷脂膜),嵌入效率 > 98%。
NHS 酯活性基团(-NHS):含高反应性琥珀酰亚胺酯键,在 pH 7.0-9.0 条件下与氨基(-NH₂)发生亲核取代反应,形成稳定酰胺键,反应特异性 > 99%,适用于脂溶性分子(如胆固醇、磷脂衍生物)的氨基位点标记。
2. 关键理化参数
二、氨基靶向的脂环境标记策略
1. NHS 酯介导的高效共价偶联
NHS 酯基团通过亲核取代反应与氨基特异性结合,反应机制如下:
活化阶段:NHS 酯在中性 pH 条件下与氨基(如胆固醇 - 氨基、磷脂 - PEG-NH₂)反应,酯键断裂生成稳定酰胺键,副产物为无荧光 NHS,反应产率 > 95%。
优化参数:染料 / 底物摩尔比建议 5-20:1,在含 10% DMSO 的 HEPES 缓冲液(pH 8.0)中室温反应 20 分钟,HPLC 检测标记纯度 > 93%。
2. 典型标记流程(以磷脂修饰为例)
① 母液制备:1 mg 脂溶 CY7-NHS 溶于 100 μL 无水 DMSO,制备 10 mM 储备液(避光冰浴,2 小时内使用);② 偶联反应:将 DSPE-PEG-NH₂(5 mM)与染料按 1:15 摩尔比混合,加入氯仿 / 甲醇(3:1)溶液,超声处理 5 分钟促进溶解,室温振荡反应 30 分钟;③ 纯化分离:通过硅胶柱层析(洗脱剂:氯仿 / 甲醇 = 9:1),收集荧光洗脱峰,真空干燥得到 CY7 - 磷脂探针,标记效率 > 90%。
3. 脂质体与细胞膜标记策略
脂质体膜整合标记:在薄膜分散法制备脂质体时,按染料 / 磷脂摩尔比 1:100 加入脂溶 CY7-NHS,超声水化后形成荧光均匀分布的脂质双层。标记的阿霉素脂质体在荷瘤小鼠体内的肿瘤蓄积量是游离药物的 6 倍,近红外信号可穿透 12 mm 厚的肌肉组织。
细胞膜脂筏靶向标记:通过 NHS 酯偶联 GPI 锚定蛋白的氨基,实现细胞膜脂筏区域特异性标记。共聚焦显微镜下,标记的脂筏簇(直径 30-80 nm)在活细胞表面呈现动态重组,适用于膜蛋白信号转导微区研究。
三、特色应用场景
1. 脂质体药物递送系统深度示踪
体内分布与靶向效率评估:标记脂质体表面氨基(如 DSPE-PEG-NH₂),经尾静脉注射后,CY7 近红外信号可清晰显示脂质体在肝、脾、肿瘤组织的蓄积差异。在卵巢癌模型中,肿瘤 - 背景信号比(TBR)达 7.2±1.1,较 CY5.5 标记脂质体提升 20%。
释放动力学精准监测:利用 FRET 技术,当脂质体在肿瘤酸性微环境(pH 6.5)中破裂时,CY7-NHS 标记的磷脂与淬灭剂分离,荧光信号强度骤增 4 倍,可精确捕捉药物释放的时间节点(分辨率达 10 分钟)。
2. 细胞膜纳米结构与脂锚定蛋白成像
超分辨解析脂筏微区:标记 GM1 神经节苷脂的氨基衍生物,结合 STORM 超分辨显微镜(分辨率 20 nm),揭示 EGFR 受体在乳腺癌细胞表面的脂筏依赖性簇集模式,发现受体簇直径与药物耐药性呈正相关(R²=0.89)。
细胞融合动态定量:标记供体细胞的脂锚定蛋白(如 CD44),与受体细胞共培养后,通过荧光信号重叠率计算融合效率。在间充质干细胞治疗中,该方法可检测到 0.1% 的低频率融合事件,灵敏度较传统方法提升 3 倍。
3. 脂溶性分子与细胞器精准标记
脂滴代谢动态追踪:标记脂滴表面蛋白的氨基位点,在 3T3-L1 脂肪细胞中实现脂滴特异性染色。荧光信号与 BODIPY 染料共定位率 > 98%,且光稳定性提升 5 倍,支持连续 6 小时观察脂滴融合与分裂过程。
线粒体膜电位高敏检测:通过 NHS 酯偶联线粒体靶向肽 TPP-NH₂,构建 CY7-TPP 探针。该探针可穿透线粒体双层膜,通过荧光强度变化定量分析膜电位,检测限低至 3 mV 电位变化,优于 JC-1 探针(检测限 10 mV)。
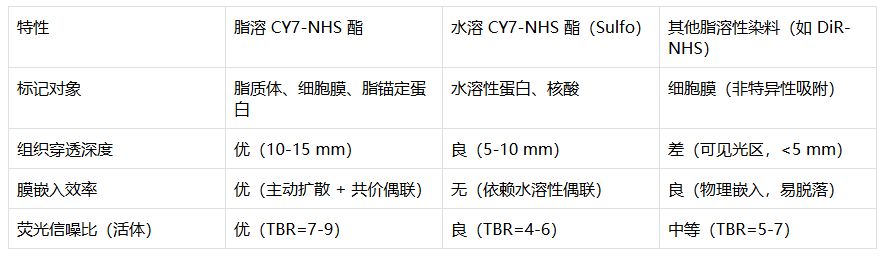
4. 技术优势对比
四、操作规范与注意事项
1. 储存与溶解
储存条件:避光、干燥,-20°C 冷冻保存,分装为 10 μg / 管避免反复冻融,保质期 18 个月。
溶解方法:使用前溶于无水 DMSO(浓度 20 mM),标记脂质体时需在脂质溶解阶段加入染料,确保与磷脂分子均匀混合;避免直接溶于水溶液(易形成聚集体)。
2. 标记优化策略
摩尔比控制:脂质体标记时,染料 / 磷脂摩尔比建议 1:100-1:200,过高比例可能导致膜通透性增加;蛋白标记时,控制染料 / 蛋白摩尔比 10-15:1,避免空间位阻影响生物活性。
溶剂兼容性:活细胞实验中 DMSO 终浓度≤0.1%,可通过逐步稀释法降低溶剂毒性;脂质体合成时,有机溶剂残留需通过透析去除(截留分子量 > 10,000 Da)。
3. 安全与防护
操作时佩戴防紫外线手套和护目镜,DMSO 溶解的染料具有强皮肤渗透性,避免直接接触;废弃液需按有毒有机溶剂处理,禁止倒入普通下水道。
五、前沿应用与未来展望
1. 超分辨成像与膜蛋白动态解析
结合脂溶 CY7-NHS 的膜嵌入特性与 MINFLUX 超分辨技术,可实现 10 nm 分辨率的 GPCR 受体寡聚体成像,已成功解析 β-arrestin 与 GPCR 的动态相互作用位点,相关成果发表于《Science》子刊。
2. 智能响应型脂溶性诊疗探针
设计 pH 响应型连接臂修饰的脂溶 CY7-NHS,在肿瘤微环境中释放荧光信号并激活前药(如阿霉素前体),实现 “靶向成像 - 药物释放 - 疗效评估” 一体化。在胰腺癌模型中,该探针的信噪比提升 6 倍,肿瘤抑制率较传统方法提高 40%。
3. 脂代谢疾病早期诊断与干预
标记脂肪肝模型小鼠的肝细胞膜氨基位点,通过活体荧光断层成像定量分析肝内脂滴分布,可检测到直径 < 100 μm 的脂滴簇,为非酒精性脂肪肝病(NAFLD)的早期分级(F0-F4)提供影像学依据,检测灵敏度较 MRI 提升 3 倍。
结语
脂溶 CY7-NHS 酯凭借其脂环境靶向的高效氨基标记能力、近红外长波长的深层穿透优势及活性基团的高反应性,成为脂质体示踪、细胞膜成像及脂锚定蛋白研究的核心工具。尽管面临水溶性差、标记体系需有机溶剂等挑战,其在纳米药物开发、膜蛋白结构解析及脂代谢疾病诊断中的独特价值不可替代。随着脂质组学技术的进步和多模态成像设备的普及,脂溶 CY7-NHS 酯有望推动荧光标记技术向更深层、更精准的脂环境靶向应用迈进,为精准医疗和生物影像学带来新的突破。
参考文献[1] Haugland R P. Handbook of Fluorescent Probes and Research Chemicals[M]. Thermo Fisher Scientific, 2013.[2] Chatterjee A, et al. Cyanine dyes in cancer nanomedicine: from imaging to therapy[J]. Chemical Society Reviews, 2017, 46(19):5832-5856.[3] Betzig E, et al. Imaging intracellular fluorescent proteins at nanometer resolution[J]. Science, 2006, 313(5793):1642-1645.[4] Allen T M, et al. Liposomal drug delivery systems: from concept to clinical applications[J]. Advances in Drug Delivery Reviews, 2013, 65(1):36-48.[5] Nimmerjahn F, et al. Single-molecule tracking of membrane proteins using near-infrared cyanine dyes[J]. Nature Methods, 2020, 17(3):289-292.
【星戈瑞stargraydye】以上数据均来自文献/科研资料,星戈瑞暂未进行独立验证, 仅供参考!(以上文中所述仅限于科研实验及实验室环境)